что значат эти буквы, какой буквой обозначается заземление
При самостоятельном подключении электрического оборудования – светильников, вентиляции, автомата пользователи могут обнаружить буквенные обозначения клемм. L, N в электрике – это фаза и земля, к которым проводят соответствующие кабели.
Содержание
- Буквенная маркировка проводов
- L – обозначение фазы
- N – буквенный символ нуля
- PE – индекс заземления
- Расцветка изоляционного покрытия проводников
- Цвет жилы заземления
- Цветовое обозначение нулевых рабочих контактов
- Расцветка фазного провода
- Зачем использовать цветовую маркировку
- Нюансы ручной цветовой разметки
- Специфика разметки двухжильного провода
- Разметка трехжильного провода
- Порядок разметки пятипроводной системы
- Как маркировать совмещенные провода
- Расцветка проводки как способ ускорения монтажа
- Требования к расцветке проводки при монтаже
Буквенная маркировка проводов
Стандарты буквенной и цветовой маркировки проводов
Для бытовых и промышленных электролиний применяются изолированные провода с внутренними токопроводящими жилами. Изделия отличаются в зависимости от цвета изоляционного покрытия и маркировки. Обозначение фазы и нуля в электрике ускоряет ремонтные и монтажные работы.
Изделия отличаются в зависимости от цвета изоляционного покрытия и маркировки. Обозначение фазы и нуля в электрике ускоряет ремонтные и монтажные работы.
Маркировка кабелей в электрических установках под напряжением до 1000 В регулируется ГОСТ Р 50462-2009:
- в п. 6. 2.1 указывается, что нулевой проводник маркируется как N;
- пункт 6.2.2. гласит, что провод защиты с заземлением обозначается PE;
- в п. 6.2.12 сказано, что в электрике L является фазой.
Понимание маркировки упрощает монтажные работы в хозяйственных, жилых и административных зданиях.
L – обозначение фазы
Обозначение L и N в электрике
В сети переменного тока под напряжением находится фазный провод. В переводе с английского слово Line имеет значение активный проводник, линия, поэтому маркируется буквой L. Фазные проводники обязательно покрываются цветной изоляцией, поскольку, находясь в оголенном состоянии, могут стать причиной ожогов, травм человека, возгорания или выхода из строя различного оборудования.
N – буквенный символ нуля
Знак нулевого или нейтрального рабочего кабеля – N, от сокращения терминов neutral или Null. При составлении схемы так маркируются клеммы коммутации нуля в однофазной или трехфазной сети.
Слово «ноль» используется только на территории стран СНГ, во всем мире жила называется нейтраль.
PE – индекс заземления
Маркировка заземления
Если проводка заземлена, применяется буквенный маркер PE. С английского значение Protective Earthing переводится как провод заземления. Аналогично будут обозначаться зажимы и контакты для коммутации с заземляющим нулем.
Расцветка изоляционного покрытия проводников
Обозначать по цветам кабели заземления, фазы и нуля необходимо в соответствии с требованиями ПУЭ. В документе установлены различия расцветки для заземления в электрощитке, а также для нуля и фазы. Понимание цветового обозначения изоляции исключает необходимость расшифровки буквенных маркеров.
Цвет жилы заземления
На территории РФ с 1 января 2011 года действует европейский стандарт МЭК 60446:2007.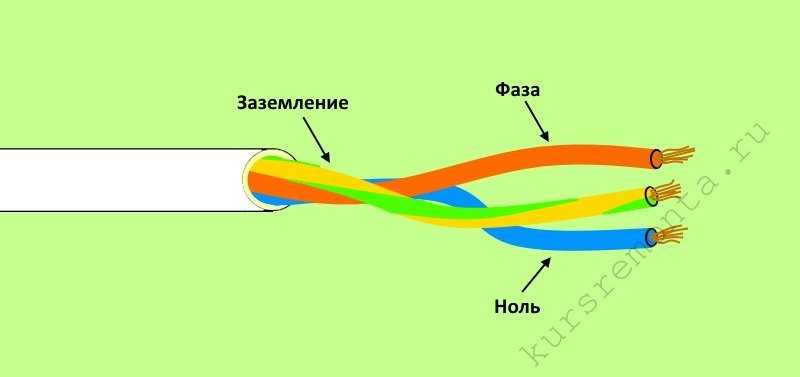 В нем отмечено, что заземление имеет только желто-зеленую изоляцию. Если составляется электросхема, земля должна обозначаться как РЕ.
В нем отмечено, что заземление имеет только желто-зеленую изоляцию. Если составляется электросхема, земля должна обозначаться как РЕ.
Жила заземления есть только в кабелях от 3-х жил.
В проводниках PEN, используемых в старых постройках, совмещены жилы земли и нуля. Изоляционное покрытие в данном случае имеет синий цвет заземления и желто-зеленые кембрики на точках соединения и концах провода. В некоторых случаях использовалась обратная маркировка – зануление желто-зеленого цвета с синими наконечниками.
Жилы земли и нуля PEN-кабелей тоньше, чем фазные.
Организация защитного заземления – обязательное условие создания электросети в жилом и промышленном строении. Его необходимость указана в ПУЭ и ГОСТ 18714-81. Стандарты гласят, что нулевое заземление должно иметь наименьший показатель сопротивления. Чтобы не запутаться, используют цветовую разметку кабелей.
Цветовое обозначение нулевых рабочих контактов
Цвет проводов в электропроводке
Чтобы не перепутать, где фаза, а где ноль, вместо букв L и N ориентируются на цвета кабелей. Электрические стандарты отмечают, что нейтраль бывает синего, голубого, сине-белого оттенка вне зависимости от количества жил.
Электрические стандарты отмечают, что нейтраль бывает синего, голубого, сине-белого оттенка вне зависимости от количества жил.
Обозначить ноль можно латинской литерой N, который на схеме читается как минус. Причина прочтения – участие нуля в замыкании электроцепи.
Расцветка фазного провода
Фаза – это токоведущая линия, которая при неосторожном касании может привести к поражению током. У мастеров-новичков часто возникают сложности с поиском кабеля. Обозначается фаза черным, коричневым, кремовым, красным, оранжевым, розовым, фиолетовым, серым и белым оттенком.
Буквенный индекс фазы – L. Он используется там, где провода не размечены цветом. При подключении кабеля к нескольким фазам рядом с литерой L ставится порядковый номер или латинские буквы А, В, С. Фазу также часто маркируют как плюс.
Фазный провод не может быть синим, голубым, зеленым или желтым.
Зачем использовать цветовую маркировку
Определить L и N в электрике можно при помощи индикаторной отвертки. Понадобится прикоснуться кончиком к части изделия без изоляционного покрытия. Свечение индикатора свидетельствует о наличии фазы. Если светодиод не загорелся, жила нулевая.
Понадобится прикоснуться кончиком к части изделия без изоляционного покрытия. Свечение индикатора свидетельствует о наличии фазы. Если светодиод не загорелся, жила нулевая.
Цветовое обозначение сокращает время на поиски нужного провода, устранение неисправности. Знание цветов проводников также исключает риски токового поражения.
Нюансы ручной цветовой разметки
Цветовая маркировка проводов с помощью кембрика
Ручная разметка применяется в момент использования проводов одинакового цвета в домах старой застройки. Перед началом работ составляется схема с цветовыми значениями проводников. В процессе укладки помечать токоведущие жилы можно:
- стандартными кембриками;
- кембриками с термоусадкой;
- изоляционной лентой.
Правила допускают использование специальных наборов для маркировки. Точки установки маркеров для обозначения нуля и фазы указаны в ПУЭ и ГОСТе. Это концы провода и места его присоединения к шине.
Специфика разметки двухжильного провода
Термоусадочная трубка для проводов
Если подключение кабеля к сети уже сделано, можно использовать индикаторную отвертку.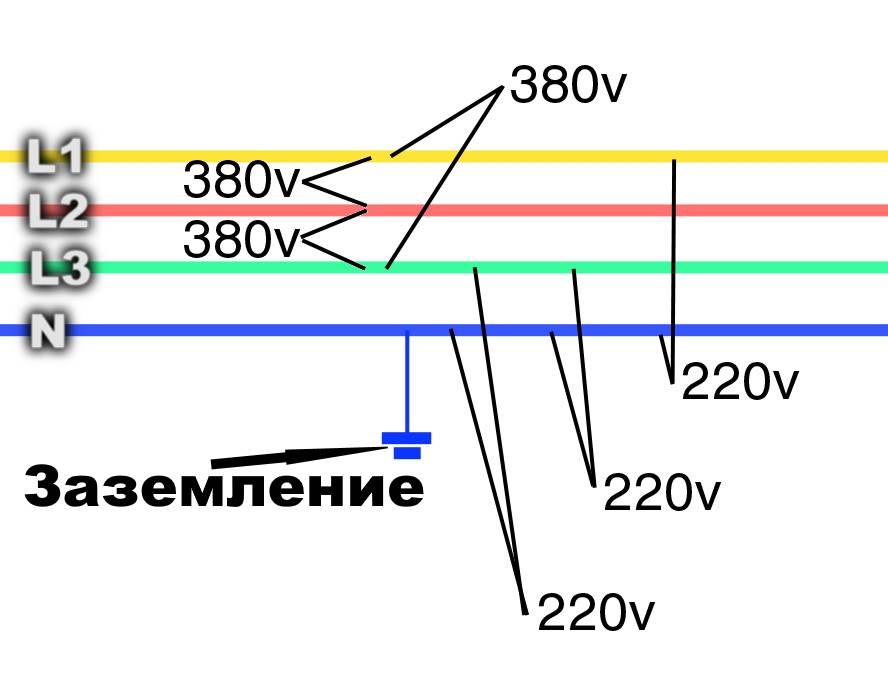 Сложность использования инструмента заключается в невозможности определения нескольких фаз. Их понадобится прозванивать мультиметром. Для предотвращения путаницы можно пометить электрический проводник цветом:
Сложность использования инструмента заключается в невозможности определения нескольких фаз. Их понадобится прозванивать мультиметром. Для предотвращения путаницы можно пометить электрический проводник цветом:
- выбрать трубки с термоусадкой или изоленты для обозначения нуля и фазы;
- работать с проводниками не по всей длине, а только на местах соединений и стыков.
Количество цветов определяется схемой. Главное при ее создании – не запутаться, не использовать желтые, зеленые или синие маркеры для фазы. Ее допускается размечать красным или оранжевым цветом.
Разметка трехжильного провода
При помощи мультиметра можно определить расположение фазы, ноля, и заземления
Для поиска фазы, заземления и нуля в трехжильном проводе целесообразно применять мультиметр. Его ставят на режим переменного напряжения и аккуратно щупами касаются фазы, потом – оставшихся жил. Показатели тестера следует записать и сравнить. В комбинации «фаза-земля» напряжение будет меньшим, чем в комбинации «фаза-ноль».
После уточнения линий можно делать маркировку. Понять, фаза – L или N, поможет соответствующая расцветка. У нуля она будет голубой или синей, у плюса – любой другой.
Порядок разметки пятипроводной системы
Электропроводка с трехфазной сети выполняется только пятижильным кабелем. Три проводника будут фазным, один – нейтральным, один – защитным заземлением. Цветовая маркировка применяется согласно нормативным требованиям. Для защиты используется желто-зеленая оплетка, для нуля – синяя или голубая, для фазы – из перечня разрешенных оттенков.
Как маркировать совмещенные провода
Для упрощения процесса монтажа проводки используются кабели с двумя или четырьмя жилами. Линия защиты тут соединяется с нейтралью. Буквенный индекс провода – PEN, где PE обозначает заземляющий, а N – нулевой проводник.
Согласно ГОСТу, используется особая цветовая маркировка. По длине совмещенный кабель будет желто-зеленым, а кончики и точки соединения – синими.
Выделяйте основные точки проблемных мест кембриками или изолентой.
Расцветка проводки как способ ускорения монтажа
Правильная расцветка проводки ускоряет монтаж электропроводки
До начала действия ГОСТ Р 50462-2009 кабели маркировались белым или черным цветом. Определение фазы и нуля производилось при расключении контролькой в момент подачи питания.
Использование цветовых маркеров упрощает ремонтные работы, обеспечивает их безопасность и удобство. Ориентируясь по оттенку кабелей, мастер не потратит много времени, чтобы провести электричество в дом или квартиру.
Рассмотреть значение цветовой маркировки можно на примере светильника. Если меняется лампа, а ноль и фаза перепутаны, имеются риски травм или летального исхода от поражения током. Когда в электрике обозначение L и N выполнено по цвету, фаза выйдет на выключатель, а ноль – на источник света. Напряжение нейтрализуется, и можно будет касаться даже включенной лампочки.
Требования к расцветке проводки при монтаже
Расключение распредкоробки
От распредкороба на выключатель протягивается медный провод с одной или двумя жилами. Количество жил зависит от количества клавиш прибора. Разрываться должна фаза, а не ноль. В процессе работы допускается использовать для запитки проводник белого цвета, делая пометку на схеме.
Количество жил зависит от количества клавиш прибора. Разрываться должна фаза, а не ноль. В процессе работы допускается использовать для запитки проводник белого цвета, делая пометку на схеме.
Розетка подключается с учетом полярности. Рабочий ноль будет слева, фаза – с правой стороны. Заземление располагается посередине устройства и зажимается клеммой.
При наличии двух кабелей одинаковой расцветки можно найти фазу и нейтраль при помощи контрольки, индикаторной отвертки, мультиметра.
На электросхеме стоит указывать, что означает L и N, но в электрике их используется несколько. На однолинейной отображена силовая часть – тип питания, количество фаз на потребителя. Здесь целесообразно начертить одну засечку на однофазной сети, три – на трехфазной и указать провода цветом. Коммутационное и защитное оборудование помечается специальными символами.
Правильная маркировка и цветовая разметка проводов обеспечивает качество монтажа и обслуживания линии. Нанесение обозначений согласно международным требованиям позволяет электрикам и домашним мастерам сориентироваться в схеме.
проводы n и l на схемах электропроводки, цветовая маркировка
Для монтажа или ремонта электрической сети требуется принципиальная схема. Несведущему человеку сложно понять смысл условных обозначений, которыми насыщен план подключения оборудования. Разобраться в предназначении проводов поможет обозначение фазы и нуля на английском языке.
- Назначение проводов в разводке
- Фазовая линия
- Обозначение нуля
- Меры предосторожности
Назначение проводов в разводке
От источника питания к потребителю электричество передаётся по многожильным проводам. Приборы и механизмы обеспечиваются энергией посредством не менее трёх линий. По кабелям фазы и нуля подаётся напряжение. Заземляющая жила защищает человека от поражения электрическим током.
Заземляющая жила защищает человека от поражения электрическим током.
Каждая линия на монтажных схемах обозначается определённым образом. Кабели, отмеченные буквами n и l, в электрике предназначены для передачи тока. «Земля» отмечается аббревиатурой PE, которая расшифровывается как Protective Earth и переводится как «защитное заземление».
Провода, предназначенные для фазы, нуля и заземления, обладают специфической окраской и маркировкой.
Различие во внешнем виде облегчает сборку сети и предотвращает ошибки электрика, приводящие к несчастному случаю или поломке прибора.
Фазовая линия
Работу сети переменного тока формируют два компонента — рабочая фаза и нулевая составляющая. Рабочая фаза, или просто фаза, является основным проводом в многожильном кабеле. По этой линии на прибор поступает электрическая энергия.
В электротехнической документации фазовый канал обозначается латинской буквой L. Допускается употребление строчной литеры l. Условному сокращению профессионалы придают разные значения. Предпочтительными вариантами считаются Lead, Live или Line. С английского языка слова переводятся соответственно как «подводящий провод», «напряжение» или «линия».
Допускается употребление строчной литеры l. Условному сокращению профессионалы придают разные значения. Предпочтительными вариантами считаются Lead, Live или Line. С английского языка слова переводятся соответственно как «подводящий провод», «напряжение» или «линия».
Если в цепи предусмотрено использование нескольких фазовых кабелей, то к букве добавляется номер фазы. По европейским стандартам, не допускающим изменения колеровки, фазовые провода окрашены в конкретные цвета:
- L 1 — коричневый.
- L 2 — чёрный.
- L 3 — серый.
В бытовой проводке на 220 вольт используются 3 линии, предназначенные для присоединения нуля, заземления и напряжения. Поэтому единственная фазовая шина покрыта изоляцией коричневого цвета. Использование кабелей другого колера считается грубым нарушением технологических норм.
Обозначение нуля
В цепи переменного тока нулевая линия необходима для создания замкнутого контура падения напряжения на контактах электрического прибора. Вместе с рабочей фазой «нуль» является основным компонентом сети.
Вместе с рабочей фазой «нуль» является основным компонентом сети.
На принципиальных схемах нулевая фаза обозначается буквами латинского алфавита N или n. Сокращённое обозначение подразумевает понятия Null или Neutral. Словари дают переводы «Нуль» и «Нейтраль».
В зависимости от гибкости кабеля, окраска нейтрального проводника представлена вариантами синего цвета. Жёсткая одножильная шина имеет насыщенный оттенок ультрамарина. Изолирующий слой многожильного провода окрашен в светло-голубой колер.
Самодеятельные мастера иногда соединяют нейтраль и заземление, ошибочно считая, что это одно и то же. Опасное заблуждение приводит к печальным последствиям. Нулевая фаза и земельная шина выполняют отличные друг от друга функции.
Различается и окраска. Защитный провод имеет жёлто-зелёный цвет. Подключение шин различного назначения в одну линию категорически запрещено техникой безопасности.
Меры предосторожности
Правильная электропроводка выполняется по регламенту IEC 60445, принятому законодательством Европы в 2010 году. Нормы российского ГОСТа 50462−2009, которые соответствуют международным правилам, указывают цвет проводов «фаза», «ноль» и «земля».
Нормы российского ГОСТа 50462−2009, которые соответствуют международным правилам, указывают цвет проводов «фаза», «ноль» и «земля».
Иногда электрикам приходится работать с сетями, которые смонтированы много лет назад, а план разводки утерян. Отсутствие принципиальной схемы делает бесполезным знание того, как обозначаются ноль и фаза. Задача электрика усложнится, если в цепи использованы провода с цветом изоляции, которая не соответствует ГОСТу.
До начала работ монтажник обязан определить назначение каждой линии с помощью контрольной лампы, индикаторной отвёртки или мультиметра. При прозванивании электрических цепей необходимо соблюдение элементарных правил техники безопасности:
- манипуляции с индикаторной отвёрткой выполняются одной рукой;
- свободной рукой нельзя прикасаться к металлическим конструкциям или стенам;
- работа проводится в присутствии квалифицированного ассистента.
Выяснив, какой провод для чего предназначен, опытный специалист маркирует линии.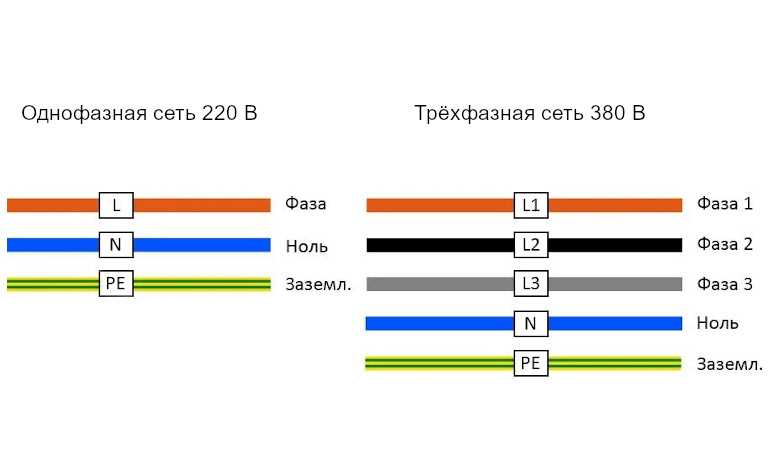 Для этого используются специальные бирки на клеевой основе или полихлорвиниловые насадки. На поверхность маркировочного материала наносятся условные обозначения на английском языке — n, l или PE. Только после окончания определительных работ приступают к монтажу или ремонту электрического оборудования.
Для этого используются специальные бирки на клеевой основе или полихлорвиниловые насадки. На поверхность маркировочного материала наносятся условные обозначения на английском языке — n, l или PE. Только после окончания определительных работ приступают к монтажу или ремонту электрического оборудования.
Понимание того, какой смысл имеют на схеме латинские буквы l и n, помогает электрику проводить монтаж и ремонт сети быстрее и качественнее. Кроме того, буквенное обозначение фазы и нуля на схеме, а также цветовая маркировка чётко определяют назначение провода, с которым работает мастер. Это предотвращает несчастные случаи на рабочем месте.
Электронная конфигурация — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1701
Электронная конфигурация атомного вида (нейтрального или ионного) позволяет нам понять форму и энергию его электронов.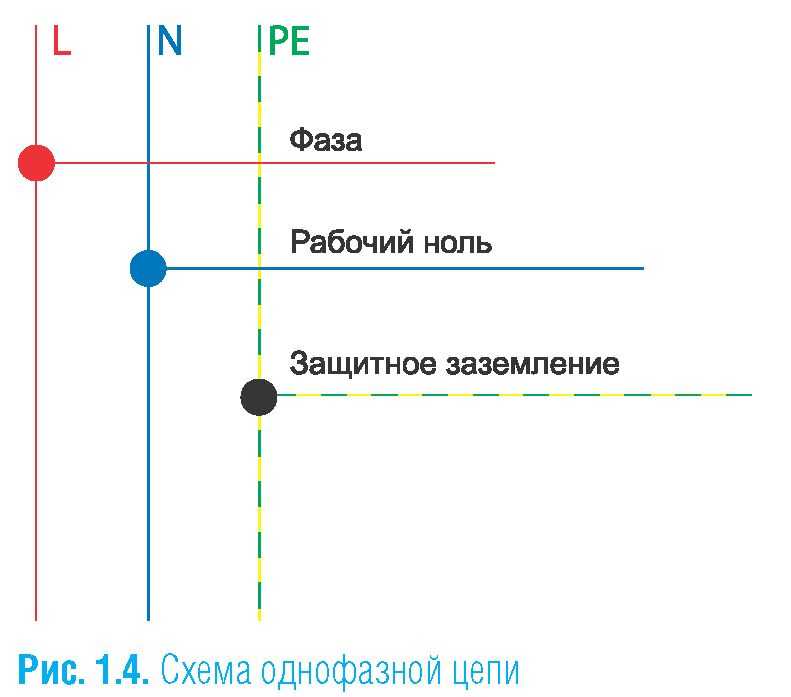 Многие общие правила принимаются во внимание при назначении «местоположения» электрона его предполагаемому энергетическому состоянию, однако эти присвоения произвольны, и всегда неясно, какой электрон описывается. Знание электронной конфигурации вида дает нам лучшее понимание его связывающей способности, магнетизма и других химических свойств.
Многие общие правила принимаются во внимание при назначении «местоположения» электрона его предполагаемому энергетическому состоянию, однако эти присвоения произвольны, и всегда неясно, какой электрон описывается. Знание электронной конфигурации вида дает нам лучшее понимание его связывающей способности, магнетизма и других химических свойств.
Введение
Электронная конфигурация является стандартной записью, используемой для описания электронной структуры атома. В орбитальном приближении мы позволяем каждому электрону занимать орбиталь, которая может быть решена одной волновой функцией. При этом мы получаем три квантовых числа (n, l , m l ), которые совпадают с числами, полученными из решения уравнения Шредингера для атома водорода Бора. Следовательно, многие из правил, которые мы используем для описания адреса электрона в атоме водорода, также можно использовать в системах, включающих несколько электронов. При назначении электронов орбиталям мы должны следовать набору из трех правил: принципу Ауфбау, принципу исключения Паули и правилу Хунда.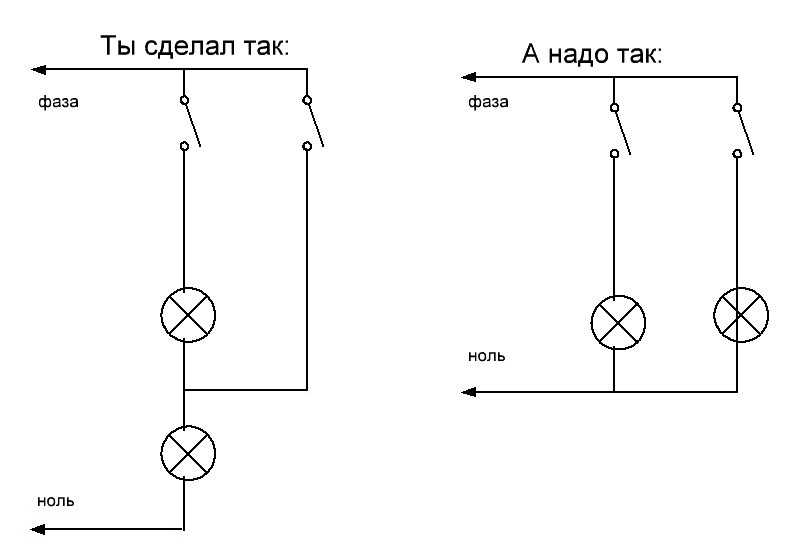
Волновая функция является решением уравнения Шредингера. Решая уравнение Шредингера для атома водорода, мы получаем три квантовых числа, а именно главное квантовое число (n), квантовое число орбитального углового момента ( l ) и магнитное квантовое число (m l ). Существует четвертое квантовое число, называемое спиновым магнитным квантовым числом (m s ), которое не получается из решения уравнения Шредингера. Вместе эти четыре квантовых числа можно использовать для описания местоположения электрона в атоме водорода Бора. Эти числа можно рассматривать как «адрес» электрона в атоме.
Обозначение
Чтобы помочь описать подходящее обозначение для электронной конфигурации, лучше всего сделать это на примере. В этом примере мы будем использовать атом йода. There are two ways in which electron configuration can be written:
I: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5
или
I: [Kr]5s 2 4d 10 5p 5
В обоих этих типах обозначений порядок энергетических уровней должен быть записан в виде увеличения энергии, показывая число электронов в каждой подоболочке в виде показателя степени. В краткой записи вы заключаете в скобки элемент благородного газа , предшествующий , за которым следует конфигурация электрона валентной оболочки. Периодическая таблица показывает, что кирптон (Kr) является предыдущим благородным газом, указанным перед йодом. Конфигурация благородного газа охватывает энергетические состояния ниже, чем электроны валентной оболочки. Следовательно, в данном случае [Kr]=1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p
В краткой записи вы заключаете в скобки элемент благородного газа , предшествующий , за которым следует конфигурация электрона валентной оболочки. Периодическая таблица показывает, что кирптон (Kr) является предыдущим благородным газом, указанным перед йодом. Конфигурация благородного газа охватывает энергетические состояния ниже, чем электроны валентной оболочки. Следовательно, в данном случае [Kr]=1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p
Квантовые числа
Главное квантовое число (n)
Главное квантовое число n указывает на оболочку или энергетический уровень, на котором находится электрон. Значение n может быть установлено от 1 до n , где n — это значение самой внешней оболочки, содержащей электрон. Это квантовое число может быть только положительным, ненулевым и целым числом. то есть n =1,2,3,4,..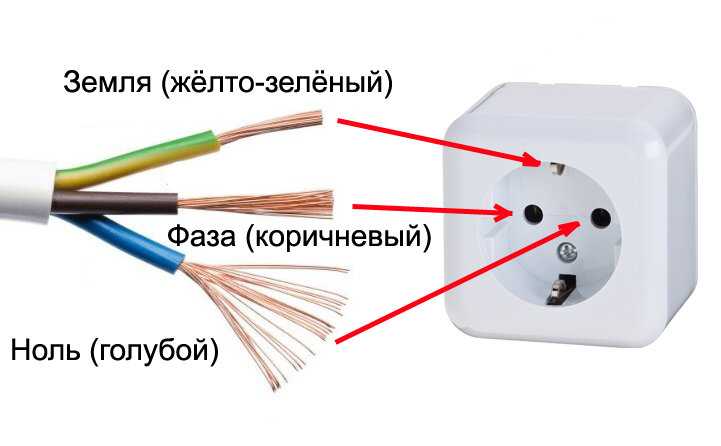
Например, атом йода имеет крайние электроны на 5р-орбитали. Следовательно, основное квантовое число для йода равно 5.
Квантовое число орбитального углового момента (
l )
Квантовое число орбитального углового момента, l , указывает подоболочку электрона. Вы также можете определить форму атомной орбитали с помощью этого квантового числа. Подоболочка s соответствует l = 0, a p 9Подоболочка 0033 = 1, подоболочка d = 2, подоболочка f = 3 и так далее. Это квантовое число может принимать только положительные и целые значения, хотя может принимать и нулевое значение. В общем, для каждого значения n существует n значений l . Кроме того, значение l находится в диапазоне от 0 до n-1. Например, если n=3, l =0,1,2.
Итак, что касается примера, использованного выше, значения l йода для n = 5 равны l = 0, 1, 2, 3, 4.
Магнитное квантовое число (m
l )
Магнитное квантовое число m l представляет орбитали данной подоболочки.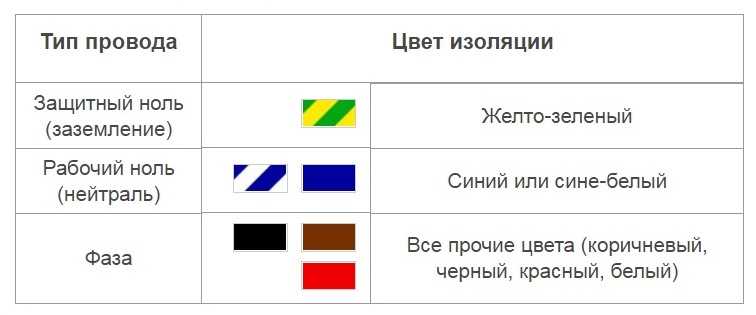 Для данного l m l может варьироваться от -l до +l . Подоболочка p ( l = 1), например, может иметь три орбитали, соответствующие m l = -1, 0, +1. Другими словами, он определяет орбитали p x , p y и p z подоболочки p. (Однако m l числа не обязательно соответствуют данной орбитали. Тот факт, что существует три орбитали, просто указывает на три орбитали p-подоболочки.) В общем, для данного l существует 2 l +1 возможных значений для m l ; а в основной оболочке n на этом энергетическом уровне находится n 2 орбиталей.
Для данного l m l может варьироваться от -l до +l . Подоболочка p ( l = 1), например, может иметь три орбитали, соответствующие m l = -1, 0, +1. Другими словами, он определяет орбитали p x , p y и p z подоболочки p. (Однако m l числа не обязательно соответствуют данной орбитали. Тот факт, что существует три орбитали, просто указывает на три орбитали p-подоболочки.) В общем, для данного l существует 2 l +1 возможных значений для m l ; а в основной оболочке n на этом энергетическом уровне находится n 2 орбиталей.
Продолжая пример выше, значения m l йода равны m l = -4, -3, -2, -1, 0 1, 2, 3, 4. Они произвольно соответствуют 5s, 5p x , 5p y , 5p z , 4d x 2 -y 2 , 4d z 2 , 4d xy , 4d xz и 4d yz 5 орбиталей.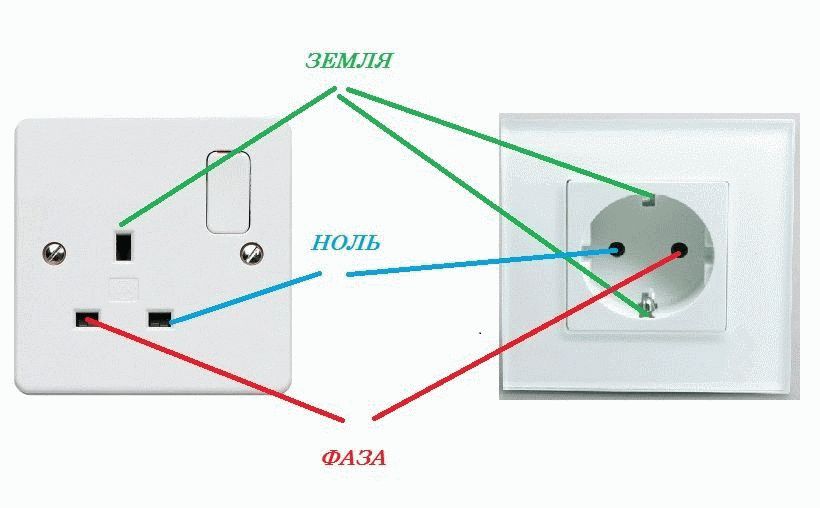
Спиновое магнитное квантовое число (m
s )
Спиновое магнитное квантовое число может иметь значение только +1/2 или -1/2. Значение 1/2 — это спиновое квантовое число s, которое описывает спин электрона. Благодаря вращению электрона создается магнитное поле. В общем случае электрон с m s =+1/2 называется альфа-электроном, а тот, у которого m s =-1/2, называется бета-электроном. Никакие два спаренных электрона не могут иметь одинаковое значение спина.
Однако Бор предположил, что из этих четырех квантовых чисел только главное квантовое число n определяет энергию электрона. Следовательно, 3s-орбиталь ( l = 0) имеет ту же энергию, что и 3p ( l = 1) и 3d ( l = 2) орбитали, независимо от разницы в значениях l . Однако этот постулат верен только для атома водорода Бора или других водородоподобных атомов.
Имея дело с многоэлектронными системами, мы должны учитывать электрон-электронные взаимодействия. Следовательно, ранее описанный постулат нарушается в том смысле, что энергия электрона теперь определяется как главным квантовым числом n, так и квантовым числом орбитального углового момента l . Хотя уравнение Шредингера для многоэлектронных атомов чрезвычайно сложно решить математически, мы все же можем описать их электронные структуры через электронные конфигурации.
Следовательно, ранее описанный постулат нарушается в том смысле, что энергия электрона теперь определяется как главным квантовым числом n, так и квантовым числом орбитального углового момента l . Хотя уравнение Шредингера для многоэлектронных атомов чрезвычайно сложно решить математически, мы все же можем описать их электронные структуры через электронные конфигурации.
Общие правила электронной конфигурации
Существует набор общих правил, которые используются для определения электронной конфигурации атомных видов: принцип Ауфбау, правило Хунда и принцип исключения Паули. Прежде чем продолжить, важно понять, что каждая орбиталь может быть занята двумя электронами с противоположным спином (что будет обсуждаться позже). В следующей таблице показано возможных числа электронов, которые могут занимать каждую орбиталь в данной подоболочке.
| подоболочка | количество орбиталей | общее количество возможных электронов на каждой орбитали |
| с | 1 | 2 |
| р | 3 (p x , p y , p z ) | 6 |
| д | 5 (D x 2 — Y 2 , D Z 2 , D XY , D XZ , D YZ ) | 10 |
| ф | 7 (F Z 3 , F XZ 2 , F XYZ , F x (X 2 -3Y 2 ) , F ), , F ), , F ). f z(x 2 -y 2 ) , f г(3x 2 -у 2 ) f z(x 2 -y 2 ) , f г(3x 2 -у 2 ) | 14 |
Используя наш пример, йод, опять же, мы видим в периодической таблице, что его атомный номер равен 53 (это означает, что он содержит 53 электрона в нейтральном состоянии). Полная конфигурация электронов — 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 6 5S 2 4D 4P 6 5S 2 4D 4P 6 5S 2 4D 0050 10 5p 5 . Если вы подсчитаете все эти электроны, вы увидите, что в сумме получается 53 электрона. Обратите внимание, что каждая подоболочка может содержать только максимальное количество электронов, как указано в таблице выше.
Aufbau Principle
Слово «Aufbau» в переводе с немецкого означает «наращивание». Принцип Ауфбау, также называемый принципом нарастания, гласит, что электроны занимают орбитали в порядке возрастания энергии. Порядок занятия следующий:
Принцип Ауфбау, также называемый принципом нарастания, гласит, что электроны занимают орбитали в порядке возрастания энергии. Порядок занятия следующий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p 9Рисунок 1. однако есть исключения, такие как медь
и хром.
Этот порядок заполнения приблизительно соответствует возрастанию энергетического уровня орбиталей. Следовательно, электроны занимают орбитали таким образом, что энергия остается минимальной. То есть подоболочки 7s, 5f, 6d, 7p не будут заполнены электронами, если орбитали с более низкой энергией, от 1s до 6p, уже полностью заняты. Кроме того, важно отметить, что, хотя математически было показано, что энергия 3d-орбитали ниже, чем у 4s-орбитали, электроны сначала занимают 4s-орбиталь, а затем 3d-орбиталь. Это наблюдение можно объяснить тем фактом, что 3d-электроны с большей вероятностью находятся ближе к ядру; следовательно, они сильнее отталкивают друг друга. Тем не менее, запоминание порядка орбитальных энергий и, следовательно, отнесение электронов к орбиталям может стать довольно простым, когда речь идет о периодической таблице.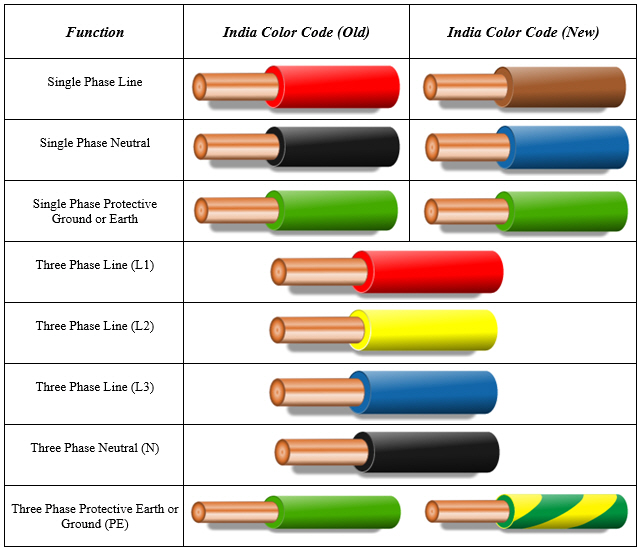
Чтобы понять этот принцип, давайте рассмотрим атом брома. Бром (Z = 35), который имеет 35 электронов, можно найти в периоде 4, группе VII периодической таблицы. Поскольку бром имеет 7 валентных электронов, 4s-орбиталь будет полностью заполнена 2 электронами, а оставшиеся пять электронов займут 4p-орбиталь. Таким образом, полная или расширенная электронная конфигурация брома в соответствии с принципом Ауфбау выглядит следующим образом:0050 6 4с 2 3д 10 4п 5 . Если мы добавим показатели степени, мы получим в общей сложности 35 электронов, что подтверждает правильность наших обозначений.
Правило Хунда
Правило Хунда гласит, что когда электроны занимают вырожденные орбитали (т.е. те же самые n и l квантовые числа), они должны сначала занять пустые орбитали, прежде чем занять их дважды. Кроме того, наиболее стабильная конфигурация возникает, когда спины параллельны (т. Е. Все альфа-электроны или все бета-электроны). Азот, например, имеет 3 электрона, занимающих 2р-орбиталь. Согласно правилу Хунда, они должны сначала занять каждую из трех вырожденных p-орбиталей, а именно 2p x орбиталь, 2p y орбиталь и 2p z орбиталь, и с параллельными спинами (рис. 2). Конфигурация ниже неверна, потому что третий электрон занимает не занимает пустую орбиталь 2p z . Вместо этого он занимает наполовину заполненную орбиталь 2p x . Следовательно, это нарушение правила Хунда (рис. 2).
Азот, например, имеет 3 электрона, занимающих 2р-орбиталь. Согласно правилу Хунда, они должны сначала занять каждую из трех вырожденных p-орбиталей, а именно 2p x орбиталь, 2p y орбиталь и 2p z орбиталь, и с параллельными спинами (рис. 2). Конфигурация ниже неверна, потому что третий электрон занимает не занимает пустую орбиталь 2p z . Вместо этого он занимает наполовину заполненную орбиталь 2p x . Следовательно, это нарушение правила Хунда (рис. 2).
Рис. 2. Наглядное представление принципа Ауфбау и правила Хунда. Отметим, что заполнение электронами каждой орбитали
(p x , p y и p z ) является произвольным, если электроны заполнены по отдельности до того, как два электрона займут одну и ту же орбиталь.
(a)Эта диаграмма представляет правильное заполнение электронами атома азота. (b) Эта диаграмма представляет неправильное
заполнение электронами атома азота.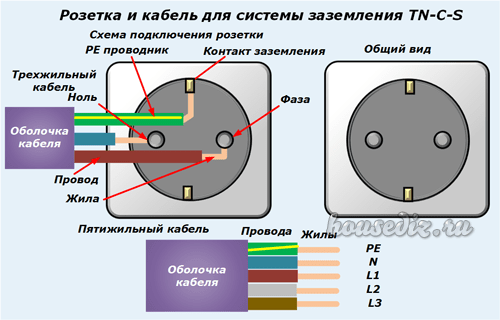
Принцип исключения Паули
Вольфганг Паули постулировал, что каждый электрон можно описать уникальным набором из четырех квантовых чисел. Следовательно, если два электрона занимают одну и ту же орбиталь, например, 3s-орбиталь, их спины должны быть спаренными. Хотя они имеют одно и то же главное квантовое число (n=3), одинаковое квантовое число орбитального углового момента (l=0) и одно и то же магнитное квантовое число (m l =0), они имеют разные спиновые магнитные квантовые числа (m s =+1/2 и m s =-1/2).
Электронные конфигурации катионов и анионов
То, как мы обозначаем электронные конфигурации катионов и анионов, в основном аналогично тому, как мы обозначаем нейтральные атомы в их основном состоянии. То есть мы следуем трем важным правилам: принципу Ауфбау, принципу исключения Паули и правилу Хунда. Электронная конфигурация катионов определяется путем удаления электронов сначала с самой внешней p-орбитали, затем с s-орбитали и, наконец, с d-орбитали (если необходимо удалить еще какие-либо электроны). Например, электронная конфигурация кальция в основном состоянии (Z=20) равна 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 . Однако ион кальция (Ca 2+ ) имеет на два электрона меньше. Следовательно, электронная конфигурация для Ca 2+ имеет вид 1s 2 2s 2 2p 6 3s 2 3p 6 . Поскольку нам нужно убрать два электрона, мы сначала удаляем электроны с самой внешней оболочки (n=4). В этом случае все подоболочки 4p пусты; следовательно, мы начинаем с удаления с s-орбитали, которая является 4s-орбиталью. Электронная конфигурация для Ca 2+ такое же, как у аргона, имеющего 18 электронов. Следовательно, мы можем сказать, что оба изоэлектронны.
Например, электронная конфигурация кальция в основном состоянии (Z=20) равна 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 . Однако ион кальция (Ca 2+ ) имеет на два электрона меньше. Следовательно, электронная конфигурация для Ca 2+ имеет вид 1s 2 2s 2 2p 6 3s 2 3p 6 . Поскольку нам нужно убрать два электрона, мы сначала удаляем электроны с самой внешней оболочки (n=4). В этом случае все подоболочки 4p пусты; следовательно, мы начинаем с удаления с s-орбитали, которая является 4s-орбиталью. Электронная конфигурация для Ca 2+ такое же, как у аргона, имеющего 18 электронов. Следовательно, мы можем сказать, что оба изоэлектронны.
Электронная конфигурация анионов определяется добавлением электронов в соответствии с принципом Ауфбау. Мы добавляем электроны, чтобы заполнить крайнюю занятую орбиталь, а затем добавляем электроны на следующую более высокую орбиталь. Нейтральный атом хлора (Z=17), например, имеет 17 электронов. Следовательно, его электронная конфигурация в основном состоянии может быть записана как 1s 2 2s 2 2p 6 3s 2 3p 5 . Ион хлорида (Cl —), с другой стороны, имеет дополнительный электрон, всего 18 электронов. Следуя принципу Ауфбау, электрон сначала занимает частично заполненную подоболочку 3p, делая 3p-орбиталь полностью заполненной. Таким образом, электронная конфигурация для Cl – может быть обозначена как 1s 2 2s 2 2p 6 3s 2 3p 6 . Опять же, электронная конфигурация для иона хлорида такая же, как у Ca 2+ и Аргон. Следовательно, все они изоэлектронны друг другу.
Нейтральный атом хлора (Z=17), например, имеет 17 электронов. Следовательно, его электронная конфигурация в основном состоянии может быть записана как 1s 2 2s 2 2p 6 3s 2 3p 5 . Ион хлорида (Cl —), с другой стороны, имеет дополнительный электрон, всего 18 электронов. Следуя принципу Ауфбау, электрон сначала занимает частично заполненную подоболочку 3p, делая 3p-орбиталь полностью заполненной. Таким образом, электронная конфигурация для Cl – может быть обозначена как 1s 2 2s 2 2p 6 3s 2 3p 6 . Опять же, электронная конфигурация для иона хлорида такая же, как у Ca 2+ и Аргон. Следовательно, все они изоэлектронны друг другу.
Задачи
1. Какой из объясненных выше принципов говорит нам о том, что спаренные электроны не могут иметь одинаковое значение спина?
2. Найдите значения n, l , m l и m s для следующего:
a. мг
мг
б. Га
в. Co
3. Какова возможная комбинация квантовых чисел 5d-орбитали? Приведите пример элемента, у которого орбиталь 5d является самой внешней орбиталью.
4. Что из следующего не может существовать (может быть более одного ответа):
a. п = 4; л = 4; м л = -2; м с = +1/2
б. п = 3; л = 2; м л = 1; м с = 1
в. п = 4; л = 3; м л = 0; м с = +1/2
д. п = 1; л = 0; м л = 0; м с = +1/2
е. п = 0; л = 0; м л = 0; m s = +1/2
5. Напишите электронные конфигурации для следующего:
a. Р
б. S 2-
в. Zn 3+
Ответы
1. Принцип исключения Паули
2. а. п = 3; л = 0, 1, 2; m l = -2, -1, 0, 1, 2; m s может быть +1/2 или -1/2
b. п = 4; л = 0, 1, 2, 3; m l = -3, -2, -1, 0, 1, 2, 3; m s может принимать значения +1/2 или -1/2
п = 4; л = 0, 1, 2, 3; m l = -3, -2, -1, 0, 1, 2, 3; m s может принимать значения +1/2 или -1/2
в. п = 3; л = 0, 1, 2; m l = -2, -1, 0, 1, 2, 3; m s может принимать значения +1/2 или -1/2
3. n = 5; л = 3; м л = 0; м с = +1/2. Например, осмий (Os).
4. а. Значение l не может быть равно 4, потому что l находится в диапазоне (0 — n-1)
b. m s может быть только +1/2 или -1/2
c. Хорошо
д. Хорошо
эл. Значение n не может быть равно нулю.
5. а. 1s 2 2s 2 2p 6 3s 2 3p 3
b. 1s 2 2s 2 2p 6 3s 2 3p 6
c. 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 7
СПИСАВ
- ATKINS, P.
 W. & De Paula, J. 2006). Физическая химия для наук о жизни. Нью-Йорк, штат Нью-Йорк: WH Freeman and Company.
W. & De Paula, J. 2006). Физическая химия для наук о жизни. Нью-Йорк, штат Нью-Йорк: WH Freeman and Company. - Петруччи, Р. Х., Харвуд, В. С., и Херринг, Ф. Г. (2002). Общая химия: принципы и современные приложения. Река Аппер-Сэдл, Нью-Джерси: Prentice-Hall, Inc.
- Шагури, Ричард. Химия 1A Лекционный сборник. 4-е изд. Пользовательская публикация. 2006. Печать
Авторы и ссылки
- Ланна Луа, Эндрю Искандар (Калифорнийский университет в Дэвисе, бакалавриат) Мэри Магсомбол (Калифорнийский университет в Дэвисе)
Конфигурация Electron распространяется по недекларированной лицензии и была создана, изменена и/или курирована LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
Определение орбитальных узлов — Химический словарь
Орбитальные узлы относятся к местам, где квантово-механическая волновая функция Ψ и ее квадрат Ψ 2 меняют фазу.
Поскольку фаза либо движется от положительной к отрицательной, либо наоборот, как Ψ, так и Ψ 2 равны нулю в узлах.
Где Ψ 2 равно нулю, электронная плотность равна нулю. Следовательно, в узле плотность электронов равна нулю.
Узлы могут быть классифицированы как радиальные или угловые .
Что такое узел?
Рассмотрим синусоидальную функцию sin x как простую волновую функцию Ψ.
На диаграмме ниже показано:
- когда sin x больше нуля, фаза волны положительна
- при грехе x меньше нуля, фаза волны отрицательная
- , когда sin x равно нулю, точка описывается как узел
.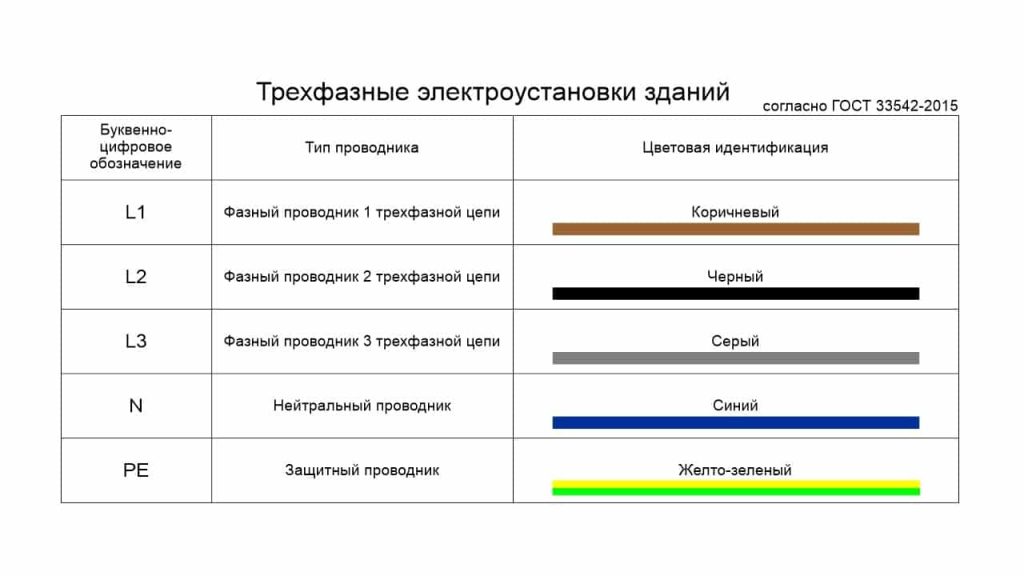
Рисунок 1
sin x против x
Теперь рассмотрим sin 2 x , квадрат исходной функции.
В квантовой химии Ψ 2 дает нам плотность электронов — она определяет размер и форму знакомых нам орбиталей s, p, d, f и т. д.
Рисунок 2
sin 2 x против x
Диаграмма выше показывает:
- sin 2 x 9003 sin 9 узлов идентичны
- значение sin 2 x не имеет отрицательных значений
- где фаза Ψ была положительной фаза Ψ 2 все еще положительная
- где фаза Ψ была отрицательной фаза Ψ 2 все еще отрицательная
- узла разделяют положительную и отрицательную фазы
Примечание по фазам и узлам
Несмотря на то, что Ψ 2 не имеет отрицательных значений,
в квантовой механике фазовая информация, которую несет исходная функция Ψ, не теряется.
По этой причине приведенный выше график sin 2 x показан с положительной и отрицательной фазами, совпадающими с положительной и отрицательной фазами исходного sin x .
Многие реальные орбитали, такие как 2s-, 2p- и 3d-орбитали, имеют области как с положительной, так и с отрицательной фазой. Эти области разделены узлами.
Например, на диаграммах ниже показаны орбитали 1s, 2s и 3s.
Обратите внимание, что орбитали 2s и 3s имеют радиальных узла , разделяющих разные фазы.
Рисунок 3
Электронные орбитали: 1s, 2s и 3s
1s 2s
Орбиталь 1s не имеет узлов; вся орбиталь находится в одной фазе. Орбиталь 2s больше и имеет один радиальный узел, разделяющий две фазы.
3s
Орбиталь 3s имеет два радиальных узла, разделяющих три фазы.
Orbital Diagrams
Figure 4
Electron Orbitals: 2p
2p
x
2p
y
2p
z
All the 2p orbitals have a single angular node , a plane, separating положительные и отрицательные фазы орбиталей. Это показано ниже серым цветом. Рис. 50034 z
Это показано ниже серым цветом. Рис. 50034 z
Трехмерные орбитали
Все трехмерные орбитали имеют два угловых узла .
В четырех орбиталях эти узлы представляют собой плоскости, разделяющие положительные и отрицательные фазы орбиталей.
В пятой орбитали узлы представляют собой две конические поверхности.
Figure 6
Electron Orbitals: 3d
3d
xy
3d
xz
3d
yz
3d
x 2 — z 2
3d
z 2
Узлы орбиты
Количество узлов
Как вы, возможно, заметили в приведенных выше орбиталях, количество узлов на орбитали подчиняется правилу.
Количество узлов всегда на единицу меньше главного квантового числа: Узлы = n — 1.
- В первой электронной оболочке n = 1. 1s-орбиталь не имеет узлов.
- Во второй электронной оболочке n = 2.
 Орбитали 2s и 2p имеют по одному узлу.
Орбитали 2s и 2p имеют по одному узлу. - В третьей электронной оболочке n = 3. Орбитали 3s, 3p и 3d имеют два узла и т. д.
Типы узла
Существует два типа узла: радиальный и угловой.
- Количество угловых узлов всегда равно квантовому числу орбитального углового момента l.
- Количество радиальных узлов = общее количество узлов минус количество угловых узлов = (n-1) — l
Примеры расчета узлов
Вторая оболочка
Во второй электронной оболочке 2s-орбиталь имеет n=2 и l=0. Количество угловых узлов = l = 0. Количество радиальных узлов = [(n-1) — l] = [1 — 0] = 1
Во второй электронной оболочке 2p-орбиталь имеет n=2 и l=1. Количество угловых узлов = l = 1. Количество радиальных узлов = [(n-1) — l] = [1 — 1] = 0
Третья оболочка
В третьей электронной оболочке 3s-орбиталь имеет n=3 и l=0. Количество угловых узлов = l = 0. Количество радиальных узлов = [(n-1) — l] = [2 — 0] = 2
В третьей электронной оболочке 3p-орбиталь имеет n=3 и l=1. Количество угловых узлов = l = 1. Количество радиальных узлов = [(n-1) — l] = [2 — 1] = 1
Количество угловых узлов = l = 1. Количество радиальных узлов = [(n-1) — l] = [2 — 1] = 1
В третьей электронной оболочке 3d-орбиталь имеет n=3 и l=2. Количество угловых узлов = l = 2. Количество радиальных узлов = [(n-1) — l] = [2 — 2] = 0
Значение фаз – конструктивное и деструктивное вмешательство
Тот факт, что фаза электронных орбиталей может быть положительной или отрицательной, имеет огромное значение для химии.
При взаимодействии орбиталей конструктивно интерферируют орбитали с одинаковыми знаками фаз.
Те, у кого разные знаки, вмешиваются деструктивно.
Примером этого является орбитальная гибридизация.
Орбитальная гибридизация
Орбитальная гибридизация имеет фундаментальное значение для понимания органической химии.
Когда s-орбиталь и p-орбиталь гибридизуются, орбитальные фазы имеют решающее значение.
Это суммировано на следующей диаграмме, где орбиталь 2s положительной фазы и орбиталь 2p взаимодействуют, образуя sp-гибридную орбиталь.



 W. & De Paula, J. 2006). Физическая химия для наук о жизни. Нью-Йорк, штат Нью-Йорк: WH Freeman and Company.
W. & De Paula, J. 2006). Физическая химия для наук о жизни. Нью-Йорк, штат Нью-Йорк: WH Freeman and Company.
 Орбитали 2s и 2p имеют по одному узлу.
Орбитали 2s и 2p имеют по одному узлу.